血小板裂解液hPL用于人T细胞的体外转导和扩增应用_曼博生物
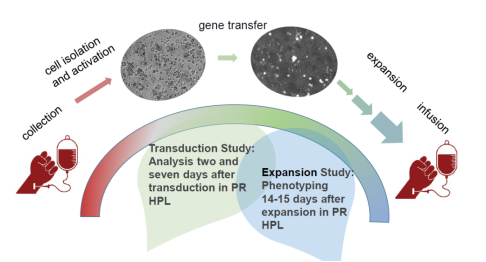
图1 使用病原体去除工艺的hPL介入的体外CAR-T免疫疗法流程
CAR-T细胞治疗的生产流程一般为通过白细胞分离技术从患者或健康供体收集单个核细胞,然后进行T细胞群富集,最后用病毒载体进行基因修饰并进行体外CAR-T细胞扩增。T细胞体外培养及扩增并非易事,国家食品药品监督管理总局组织制定的《细胞治疗产品研究与评价技术指导原则(试行)》中有明确指出:“细胞培养过程中,应尽量避免使用动物来源的物质,比如应尽量避免血清的使用,若必须使用血清,需要提供相关的研究资料说明使用的必要性和合理性;严禁使用疫病流行区来源的动物血清;不得使用未经过安全性验证的血清” 。
图2 FDA关于细胞治疗产品研究与评价技术指导原则通告
因此,需要探索更加安全、成分更加明确的血清替代物对于细胞治疗产品的稳定持续生产。
一、实验方法和准备
本研究使用人外周血T细胞,按照细胞标准处理流程,进行T细胞解冻和激活(CD3/CD28 T细胞激活剂)。使用含有IL-2和不同浓度细胞培养补充剂包括:美国Sexton品牌的PR hPL(病原体减少工艺制备的血小板裂解液以下简称hPL)、人AB血清、胎牛血清FBS的培养基,在12孔板中进行培养;解冻4天后使用CMV-GFP慢病毒颗粒进行体外转导;使用血细胞计计数细胞进行T细胞扩增研究;使用抗CD4(rpat4)、抗CD8(rpa-t8)、抗CD45RO(uchl1)、抗CCR7(151503)、抗CD127(HIL-7R-M21)、抗CD62L(sk11)抗体进行免疫染色,从而获得相应的流式细胞检测数据为进行T细胞表型研究。
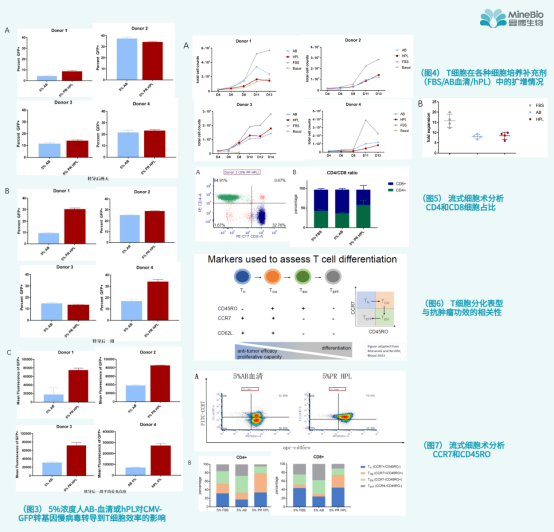
实验一:hPL和人AB血清对慢病毒转导T细胞效率的影响
上图3A中显示使用5%浓度的AB血清和hPL培养的T细胞在慢病毒转导两天后的GFP阳性百分比,一般转导后两天为这两种培养补充剂对T细胞培养的间接影响预计Zui小的时间点。B图中显示转导一周后GFP阳性的百分比, 这是可能间接影响结果的时间点。转导一周后的平均荧光强度在C图中显示。每张图图数据显示了来自一个供体的重复(n=3)的平均值和标准偏差。
通过以上实验结果发现:作为T细胞培养补充剂,5%的使用浓度下,相比较人AB血清,使用该hPL进行体外T细胞培养具有相似的病毒转导效率。
实验二—hPL对T细胞扩增效率的影响
研究者继续就T细胞在各种细胞补充剂中的扩增情况进行分析,将T细胞在含有5%不同补充剂(FBS/AB血清/hPL)的培养基中培养和扩增。在指定的日期内进行细胞总数计数。下图4A中显示4名捐赠者的测试结果,B图显示的是在第13天或第14天获得的总扩增情况进行统计学计数。
通过以上实验结果发现:作为T细胞培养补充剂,5%的使用浓度下,相比较人AB血清,使用该hPL进行体外T细胞培养具有相似的扩增倍数。
实验三—hPL对于T细胞培养CD4和CD8细胞比例的影响
下图5A显示FACS数据来自一个供体外周血中分离的T细胞经5%浓度的hPL培养后经流式细胞仪分析的CD4和CD8细胞分布的散点图。B图显示了在含有不同5%补充剂的培养基中培养和扩增14天后的CD4/CD8比值的平均值和标准差(来自4个供体)。
通过以上实验结果发现:使用5% 的hPL作为细胞补充剂进行T细胞体外培养,有助于维持T细胞CD4/CD8比例在40/60-60/40的范围内。
实验四—hPL有助于T细胞较低分化水平的维持
本次研究中,我们重点研究了T细胞分化相关的三类markers:CD45RO/CCR7/CD62L。下面7A中流式细胞分布数据点图显示了5%浓度的不同细胞补充剂培养的T细胞(CD4+亚群)表型分析,与人AB血清相比,hPL具有较少的不良分化TEM/ TEFF(CCR7细胞)。所有被测试的四个供体都显示了这种表型的变化。CD8亚群的细胞也显示出一致的趋势,因篇幅问题这里就不一一演示了。7B图中汇总数据显示了在不同细胞补充剂中,TN, TCM, TEM, TEFF各自占比(左:CD4+亚群、右:CD8+ 亚群) 。
进一步的,细胞解冻后在含FBS/人AB血清/hPL补充剂的培养基中培养14-15天。下图8A中显示一个供体使用不同细胞补充剂的T细胞的CD62L荧光分布直方图。左为CD4+亚群T细胞,右为CD8+亚群T细胞。图B中显示了来自三个供体的CD62L+百分比和个体重复百分比的平均值和标准差。组间采用统计分析进行单向方差分析。(*=p<0.05,**=p<0.001)
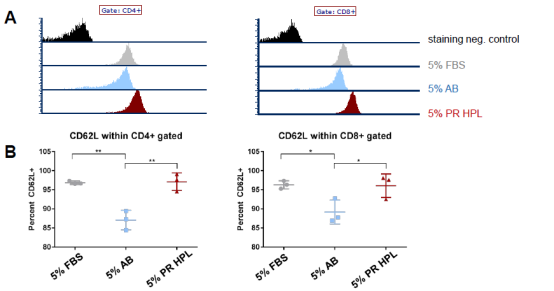
图8 流式细胞术分析经不同培养补充剂培养的T细胞亚群的CD62L分析
通过以上实验结果发现:hPL作为细胞补充剂进行T细胞体外培养,有助于支持T细胞维持较低的分化水平状态。
综上所述,在本次研究中使用美国Sexton品牌的血小板裂解液hPL替代FBS或者人AB血清的实验结果比较:
1)使用hPL作为血清替代物培养T细胞,转导效率、T细胞扩增率并无明显影响;
2)使用hPL作为血清替代物培养T细胞,有助于维持T细胞CD4/CD8比例在40/60-60/40的范围内;
3)使用hPL作为血清替代物培养T细胞,获得的TN/ TCM比例相对较高,TCM也为AB血清培养组的3-5倍,有文献记载TN/TM表型的维持与对于肿瘤长期杀伤能力的改善有一定相关性(J clininvest . 2008: Hinrichs et al., Proc Natl academy Sci USA 2009)。
此外,值得期待的是:当T细胞在hPL中培养时,某些转基因表达更稳定意味着实现类似功能效果所需的慢病毒数量的减少。
因此美国Sexton品牌的血小板裂解液hPL替代FBS或者人AB血清是CAR-T细胞治疗的中T细胞体外培养的理想培养基补充剂选择,目前在世界范围内有百个使用该品牌hPL产品的项目在临床阶段,且有相关文献分享。
想了解更多Sexton产品相关信息,欢迎联系上海曼博生物!



