O+Y突破性疗法治疗肝癌获FDA优先审评资格
中国医学论坛报今日肿瘤
2019临近尾声,一年来,肝癌治疗领域的创新进展可圈可点。单药、联合治疗不断推进,其中,免疫+免疫联合治疗方案可谓自成一格——近日,美国食品与药物管理局(FDA)接受了纳武利尤单抗(欧狄沃,O药)联合伊匹木单抗(Y药)用于既往接受过索拉非尼治疗的晚期肝细胞癌(HCC)患者治疗方案的补充生物制剂许可申请(sBLA),并授予该联合治疗方案突破性疗法认定与优先审评资格。至此,CheckMate-040 I/II期临床研究在肝癌治疗历史上的深远意义又添一笔重彩。

秦叔逵教授
基于这一进展以及CheckMate-040研究的开拓性意义,我们特别邀请到解放军东部战区总医院秦叔逵教授就当前肝癌诊疗现状进行深度讲解,以进一步探索免疫治疗方案在肝癌治疗中的作用及前景,为我国肝癌诊疗发展指明方向。
获FDA优先审评资格 O+Y双联击“肝”于突破
HCC不仅是中国癌症治疗的一大难题,着眼全球,HCC导致的死亡数增长亦排名前列,在美国,其是所有癌症中致死率增长最快的癌种。因此,HCC领域的研究一直是学界最为关注的焦点之一。尽管近年来,HCC治疗领域进展重大,但患者的预后却依然不尽如人意,仍有极大且未被满足的治疗需求亟待解决。
在美国,FDA突破性疗法认定是通过加快针对严重疾病的药物开发和审查过程让患者能够获得及时有效治疗的一项流程。获得突破性疗法认定的治疗药物需要在其初步的临床证据中证实,其能够在一个或多个具有重要临床意义的研究终点上,体现出相较于现有药物治疗的实质性改善。此次,FDA对O+Y方案用于肝癌的突破性疗法认定与优先审评资格的认可,不仅为美国HCC患者带来了希望,同时也在一定程度上为全球HCC治疗提供了方向性的引导。
追本溯源,此次优先审批认定所基于的研究是CheckMate-040研究中队列4(O+Y)的治疗结果,该队列旨在评估免疫肿瘤(I-O)联合疗法用于既往接受过索拉非尼治疗的晚期HCC患者的疗效。在今年召开的2019年美国临床肿瘤学会(ASCO)年会上,CheckMate-040首次发布的O+Y治疗晚期HCC的临床研究结果,显示出该免疫联合治疗在HCC应用中的巨大潜力。
CheckMate-040循证数据盘点 免疫开拓“肝”为人先
作为肝癌免疫治疗史上里程碑式的研究,正在进行中的I/II期开放标签、多队列临床研究CheckMate-040旨在评估纳武利尤单抗单药或者以纳武利尤单抗为基础的联合治疗方案对晚期肝细胞癌患者的疗效与安全性。纳入的患者包括原有或无慢性病毒性肝炎,既往未接受过索拉非尼治疗,或接受索拉非尼治疗后不耐受或病情进展等各类情况。目前,研究所包含的6个队列结果已共同促其成为引领肝癌免疫治疗的风向标。
而本次FDA认证的O+Y队列(CheckMate -040研究队列4)研究探索性地评估了三种纳武利尤单抗与伊匹木单抗联合给药方案在索拉非尼经治HCC患者中的安全性和有效性。该队列共纳入148例伴或不伴有乙型肝炎病毒(HBV)/丙型肝炎病毒(HCV)感染的晚期HCC患者,其中146例患者接受过索拉非尼治疗,按1:1:1比例随机分为三组,接受剂量及频次不同的治疗方案2。
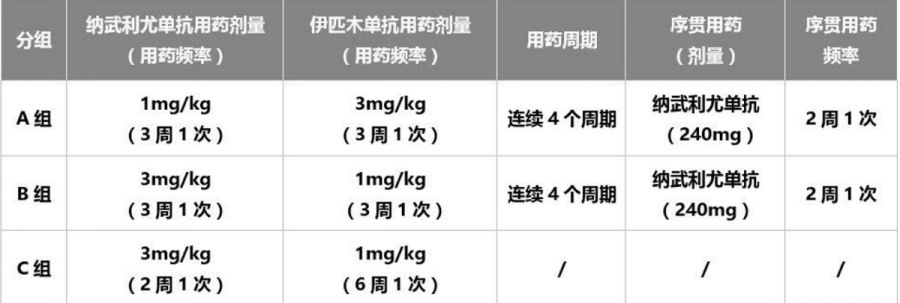
该队列研究首次证实纳武利尤单抗联合伊匹木单抗在晚期肝癌中疗效显著且安全性可控:
(一)三个治疗组患者中均观察到临床获益
总体人群中,患者客观缓解率(ORR)为31%(46/148),其中包括7例完全缓解,疾病控制率(DCR)为49%(72/148),数据截止时,中位缓解持续时间(mDoR)为17.5个月。同时,三组患者的ORR、DCR和中位DoR结果相似(图1),在各组都观察到ORR>30%;DCR分别为54%、43%和49%;中位DoR为17.5、22.2和16.6个月。

图1 三个治疗组患者的疗效评估结果
(二)临床获益转化为生存优势
三组患者的中位OS分别为22.8个月、12.5个月和12.7个月,24个月OS率分别为48%、30%和42%。可以看出,其中A组患者的中位OS最长,达22.8个月,30个月OS率为44%(图2)。
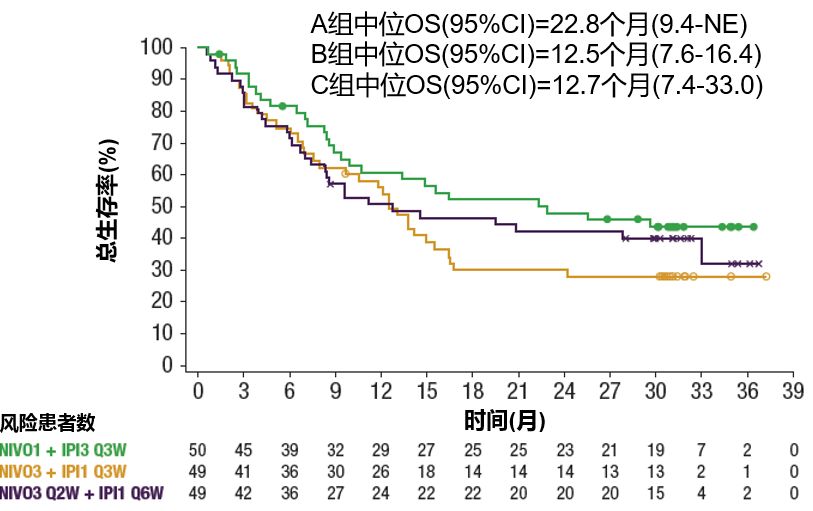
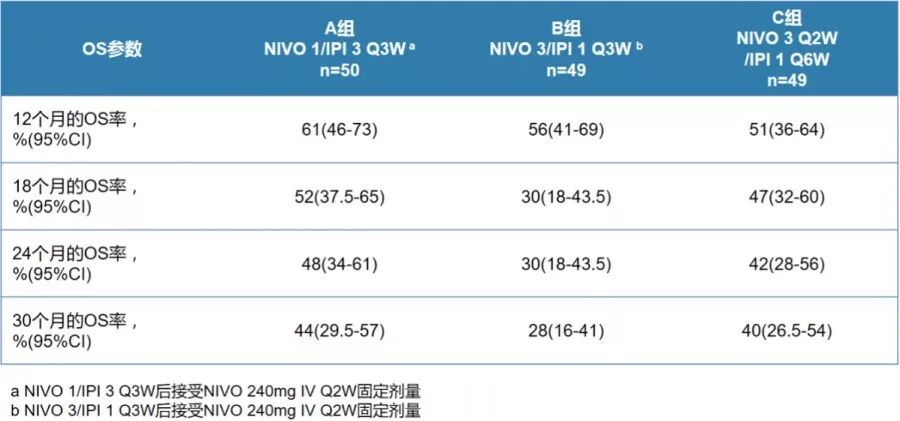
图2 三个治疗组患者的生存数据结果
(三)免疫获益不受PD-L1表达限制
无论肿瘤组织的PD-L1表达水平如何,都有显著疗效。在基线PD-L1<1%和PD-L1≥1%的患者中,均观察到ORR和OS获益。
(四)安全性可控,未出现新增的不良反应
三组患者的治疗相关不良事件(TRAEs)发生率分别为94%、71%和79%。其中,最常见的3~4级TRAEs包括瘙痒、皮疹、腹泻、天门冬氨酸氨基转移酶升高和脂肪酶升高。总体不良事件属于可逆、可控范围内,均未观察到因增加伊匹木单抗而出现的新的安全性信号,患者耐受性较好。
综合1+1>2的疗效优势,加之良好的安全性,取得生存期有效延长的亮眼“成绩单”后,肝癌免疫联合治疗首战告捷,O+Y队列的实战结果正是获得FDA突破性认证与优先审查资格认可的重要砝码。
当然,CheckMate-040研究的重要意义,并不限制于这一队列。作为肝癌免疫治疗领域的关键研究,CheckMate-040研究还凭借队列1、2证明了纳武利尤单抗单药在不同疾病原因、不同阶段、不同地区的晚期肝癌患者治疗中的欣喜结果,其一线治疗ORR约20%,二线ORR约15%左右的飞跃进步成为了免疫新时代最好的证明3,其良好的亚洲人群获益成果也为“中国特色”肝癌难题提出了解决方案4。此外,其设计的全面性体现在纳入了不同疾病原因、不同阶段、不同地区的肝癌患者之余,更有队列5展现了对于预后较差的Child-Pugh B级晚期HCC患者未尽需求的考量。
可见,在CheckMate-040研究丰富的临床研究结果奠基之上,免疫肿瘤药物治疗已在肝癌系统性治疗中站稳脚跟,在继纳武利尤单抗获得FDA加速批准用于二线HCC治疗以及O+Y方案获得FDA授予优先审评与突破性疗法认证之后的未来新征程,值得更多的期待。
立足单药探索联合 免疫一线“肝”知无限
近十年来,肿瘤免疫治疗可谓在推动抗肿瘤治疗领域取得了突飞猛进的成果。免疫治疗药物在肿瘤领域临床研究中显示出较既往治疗方案的优势,使得抗肿瘤治疗领域学者对免疫肿瘤药物的应用以及与其他治疗手段的联合寄予了更多期望。
自2015年起,肝癌免疫治疗研究结果陆续公布,向“癌王”肝癌的治疗僵局不断发起总攻,其中CheckMate-040研究作为其中的先头部队,在推动免疫治疗在肝癌领域中的发展这一进程中,有着举足轻重的地位。值得注意的是,在CheckMate-040研究中,纳武利尤单抗在未经索拉非尼治疗的HCC患者中同样收到的较好的治疗数据,让我们看到了PD-1单抗前移至一线治疗的潜力和机遇。
此外,一项随机、多中心的III期临床试验CheckMate 9DW也于今年9月正式启动。秦教授指出,CheckMate 9DW研究将纳入中国人群,旨在评估纳武利尤单抗联合伊匹木单抗治疗方案对比标准治疗方案(索拉非尼或仑伐替尼)一线治疗不可切除HCC患者中的疗效和安全性,结果值得期待。
展望未来,临床实践当中仍需要积极推动多学科合作,有计划、合理地联合应用多种治疗方法及药物开展综合治疗。相信随着肝癌发病机理与免疫机制被进一步解锁、以及更多一线治疗临床研究的开展,肝癌免疫治疗必会成为日后综合治疗中不可或缺的一环,成为治疗大势之所趋。我们也有理由期待,未来将有更多免疫突破能更早一步地给肝癌患者的生命以更长久的时光。
注:目前尚无免疫肿瘤治疗药物在中国大陆获批肝癌适应证。
参考文献
[1]Hashem B. El-Serag, Hepatocellular Carcinoma, N Engl J Med 2011; 365:1118-1127
[2]Thomas Yau, et al. Nivolumab (NIVO) + ipilimumab (IPI) combination therapy in patients (pts) with advanced hepatocellular carcinoma (aHCC): Results from CheckMate -040. Abstract and Poster #4012. Presented at the American Society of Clinical Oncology Annual Meeting; May 31–June 4, 2019; Chicago, IL, USA.
[3]El-Khoueiry, A.B., Sangro, B., Yau, T. et al. nivolumab in patients with advanced hepatocellular carcinoma (CheckMate-040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial[J]. Lancet, 2017. Jun 24;389(10088):2492-2502.
[4]Hsu C., et al. nivolumab in advanced hepatocellular carcinoma (aHCC): Asian Cohort Analysis from the CheckMate-040 study. Poster presented at 2018 CSCO. 2018 Sep.



